Conceptos fundamentales
En este tutorial, aprenderá a calcular el porcentaje de rendimiento y el rendimiento teórico, y cómo calcularlo. Además, verá un ejemplo de cálculo.
Temas tratados en otros artículos
- Cálculo de la Masa Molar
- Cómo leer la tabla periódica
- Fórmula Molecular vs. Fórmula Empírica
- Reacciones Químicas Fáciles
¿Qué es el rendimiento porcentual?
Cuando se realiza un experimento, existe un rendimiento máximo que se puede obtener si las condiciones de reacción son perfectas; éste es el rendimiento teórico. Sin embargo, aunque sigas un experimento correctamente, es probable que no obtengas un rendimiento perfecto del producto; la cantidad de producto que obtienes al final es tu rendimiento real.
El porcentaje del rendimiento teórico que has obtenido en tu experimento es el porcentaje de rendimiento. Aprendamos a calcularlo abajo.

Cómo calcular el porcentaje de rendimiento
Puedes utilizar la siguiente ecuación para calcular el rendimiento de un experimento:
![]()
Qué es el rendimiento teórico
El rendimiento teórico es la cantidad máxima de producto que puede obtenerse de una reacción química. Se calcula a partir de la estequiometría de la reacción, que es el estudio de las proporciones de los reactantes y los productos en una reacción química. El rendimiento teórico se determina utilizando la ecuación química balanceada de la reacción y las cantidades conocidas de los reactantes.
Por ejemplo, si tenemos ![]() de reactivo A y
de reactivo A y ![]() de reactivo B, y la ecuación química balanceada de la reacción es
de reactivo B, y la ecuación química balanceada de la reacción es ![]() , entonces el rendimiento teórico del producto C sería de
, entonces el rendimiento teórico del producto C sería de ![]() , porque es la cantidad máxima que se podría producir a partir de la cantidad dada de reactantes. Sin embargo, en la realidad, el rendimiento real de una reacción suele ser inferior al rendimiento teórico, debido a diversos factores como la conversión incompleta de los reactantes o la pérdida de producto durante la reacción.
, porque es la cantidad máxima que se podría producir a partir de la cantidad dada de reactantes. Sin embargo, en la realidad, el rendimiento real de una reacción suele ser inferior al rendimiento teórico, debido a diversos factores como la conversión incompleta de los reactantes o la pérdida de producto durante la reacción.
Cálculo del rendimiento teórico
Primero, debe calcular el rendimiento teórico de su experimento; normalmente, esto implicará cálculos estequiométricos. Observando la ecuación química y la información proporcionada, puede hacerse una idea de lo que está reaccionando y cómo se forma el producto.
El siguiente paso es identificar el reactivo limitante, ya que no se puede formar más producto una vez que se agota el reactivo limitante.
A continuación, se puede utilizar el análisis dimensional para ver la cantidad de producto que puede formarse en función de la cantidad de reactivo limitante administrada. Éste es el rendimiento teórico de su experimento.
Cálculo del rendimiento real
Si está realizando físicamente un experimento, su rendimiento real será la cantidad de producto que pese en su balanza. Si está realizando un problema de planteo, el rendimiento real puede aparecer en el problema.
Ecuación del porcentaje de rendimiento
El último paso, una vez que tienes el rendimiento teórico y el real, es introducir los números en la ecuación. Dividiendo el rendimiento real por el teórico se obtiene la fracción de producto que se ha obtenido. Multiplicando por 100 se obtiene el porcentaje de rendimiento.
Ejemplo de cálculo del rendimiento porcentual
Ahora que conocemos los pasos para calcular el rendimiento, veamos un ejemplo:
Utilice la siguiente reacción química balanceada. Si se utilizan ![]() de acetileno (C2H2) y
de acetileno (C2H2) y ![]() de oxígeno, y se producen
de oxígeno, y se producen ![]() de agua, ¿cuál es el porcentaje de rendimiento?
de agua, ¿cuál es el porcentaje de rendimiento?
![]()
El primer paso es encontrar el reactivo limitante y el rendimiento teórico del agua:
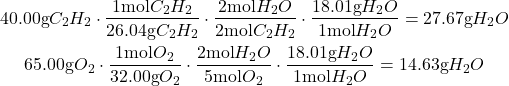
Utilizando el análisis dimensional en ambos reactivos, se encuentra que el agua produce una menor cantidad de producto que el oxígeno; debido a esto el agua es nuestro reactivo limitante.
![]() es nuestro rendimiento teórico. El último paso es conectar nuestros números en la ecuación de rendimiento porcentual.
es nuestro rendimiento teórico. El último paso es conectar nuestros números en la ecuación de rendimiento porcentual.
![]()
Nuestro rendimiento es ![]() .
.
Para ver más preguntas de ejemplo, ¡haz clic aquí!
Calculating Percent Yield Practice Problems
Problema 1
Se mezclan ![]() de MgCl2 y
de MgCl2 y ![]() de AgNO3 y se recuperan
de AgNO3 y se recuperan ![]() de AgCl. Calcular el rendimiento.
de AgCl. Calcular el rendimiento.
El MgCl2 y el AgNO3 reaccionan según la siguiente ecuación:
![]()
Problema 2
Se dejan caer ![]() de sodio elemental (Na) en
de sodio elemental (Na) en ![]() de agua y se recogen
de agua y se recogen ![]() de H2. Calcula el porcentaje de rendimiento. El sodio y el agua reaccionan de acuerdo con la siguiente reacción:
de H2. Calcula el porcentaje de rendimiento. El sodio y el agua reaccionan de acuerdo con la siguiente reacción:
![]()
Cálculo del rendimiento porcentual Soluciones de problemas de práctica
1: ![]()
2: ![]()
